Кислоты и щелочи в строительстве
Кислоты
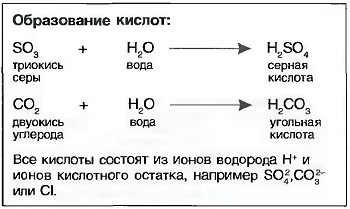
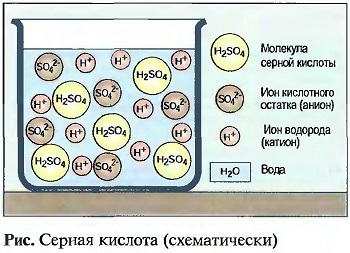
Кислоты получаются, когда оксиды неметаллов растворяются в воде, например угольная кислота (Н2СО3) или серная кислота (H2SO4). Также и соединения неметаллов (галогены) хлор и фтор с водородом при растворении в воде образуют соляную кислоту (НСl) или фтористую кислоту (HF). Их называют кислородными кислотами (рис. «Серная кислота»).
 |
 |
Образование ионов
Молекулы кислот могут в водных растворах полностью или частично расщепляться на водородные ионы (Н*) и остаточные ионы кислоты, например, на ионы (SO4-2) или (С03-2). Поэтому кислоты проводят электрический ток (электролиты). Кислородные ионы называют катионами, а ионы кислотного остатка — анионами.
ПРИМЕРЫ:
Серная кислота H2SO4 вода ► H+ H+ SO42-
Соляная кислота НСl вода ► Н+ Сl—
Азотная кислота HNO3 вода ► Н+ NO3—
Свойства кислот определяются отколовшимися ионами водорода. Поэтому кислоты действуют только в водных растворах. Сила действия кислоты зависит от того, сколько ионов водорода отделилось.
СИЛЬНЫЕ КИСЛОТЫ: соляная кислота (НСl), азотная кислота (HNO3), серная кислота (H2SO4).
СРЕДНЕСИЛЬНЫЕ КИСЛОТЫ: фосфорная кислота (Н3РO4), фтористая кислота (HF).
СЛАБЫЕ КИСЛОТЫ: угольная кислота (Н2С03), синильная кислота (HCN).
Важнейшие кислоты
СОЛЯНАЯ КИСЛОТА (НСl) разлагает известняк (СаСO3) при отделении двуокиси углерода (СО2). Разбавленная соляная кислота применяется для очистки (раскисления) кирпичной кладки и для удаления известковых отложений.
СЕРНАЯ КИСЛОТА (H2SO4) как составляющая часть «кислотных дождей» образует вместе с не растворимыми в воде известняками (СаO3) водорастворимый сульфат кальция (CaSO4), который, как гипс, либо уносится вместе с водой, либо приводит к повреждениям строительных конструкций за счет кристаллизации «сульфатации» и связанным с ней увеличением объема и отслоением материала. Серная кислота сильно притягивает воду (она гигроскопична). Поэтому при разбавлении водой необходимо кислоту вливать в воду!
УГОЛЬНАЯ КИСЛОТА (Н2СO3) образуется в основном соединением дымовых газов, содержащих СO2 с влажностью воздуха или с дождевой водой. Вода, содержащая угольную кислоту, разлагает содержащие известь вяжущие вещества. Угольная кислота при этом соединяется с известковой составляющей и образует водорастворимую соль — гидрогенкарбонат кальция (Са(НСO3)2).
АЗОТНАЯ КИСЛОТА (HNO3) состоит из аммиака (NH3), который получается при разложении органических материалов, например в канализационных коллекторах или в хлевах сельскохозяйственных животных. Вместе с содержащими известь строительными материалами образуется растворимый в воде нитрат кальция (CaNO3), который известен как «стеновая селитра» и может привести к повреждениям строительных конструкций. Азотная кислота является сильным окислителем. При взаимодействии с органическими материалами, например с деревом или текстилем, эти материалы могут загореться.
СВОЙСТВА:
- Кислоты окрашивают лакмусовую бумагу в красный цвет.
- Кислоты раздражают кожу и разрушают одежду.
- Кислоты реагируют с большинством металлов и со многими органическими веществами.
- Кислоты имеют кислый вкус.
- Кислоты могут привести к разрушениям строительных конструкций.
Щелочи
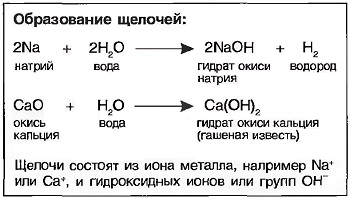
Щелочи получаются путем реакций щелочных металлов, например натрия (Na), или водорастворимых окислов металлов, например окись кальция (СаО), с водой. При выпаривании воды получают в большинстве случаев твердую бесцветную массу гидрата окиси металла, называемого также основанием. Однако щелочное действие наступает только тогда, когда гидрат окиси растворяется в воде (рис. Натриевая щелочь).
 |
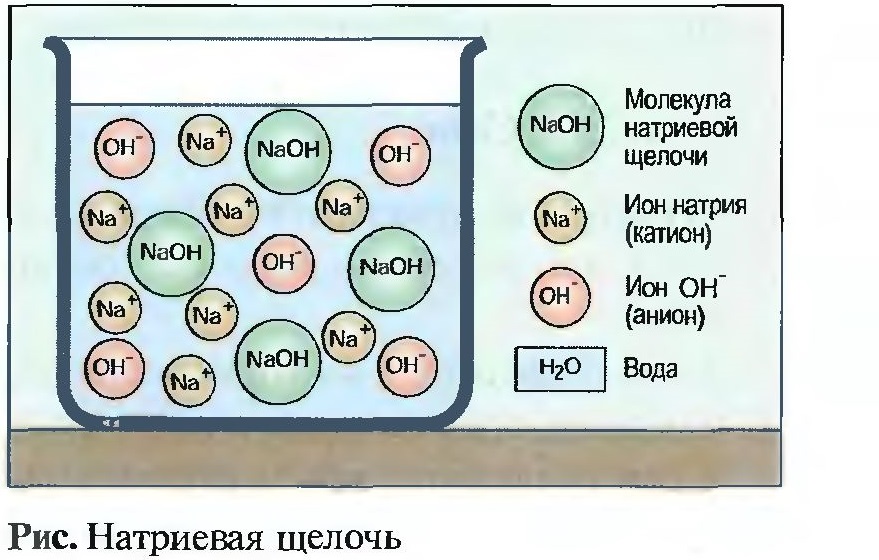 |
Образование ионов
Молекулы щелочи распадаются в водном растворе частично или полностью на положительно заряженные ионы металла, например на Na+ ионы (катионы) и отрицательно заряженные ионы ОН— (анионы).
ПРИМЕРЫ:
Натриевая щелочь NaOH —► Na+ ОН
Кальциевая щелочь Са(ОН)2 —► Са+ ОН— ОН—
Щелочи проводят электрический ток и поэтому называются электролитами. Свойства щелочей определяются ионами ОН, причем количество отделившихся ионов ОН определяет силу щелочи.
СИЛЬНЫМИ щелочами являются натриевая щелочь (NaOH), калиевая щелочь (КОН) и кальциевая щелочь (Са(ОН)2).
СЛАБОЙ щелочью является водный раствор газа — аммиака, который называется нашатырем (NH4OH).
ГАШЕНАЯ ИЗВЕСТЬ — это натриевая щелочь. Она применяется для приготовления строительных растворов.
ИЗВЕСТКОВОЕ МОЛОКО — это разбавленная водой гашеная известь.
Величина PH
На практике часто требуется установить, насколько сильным является раствор как кислота или основание. Мерой этому служит величина pH. Она может меняться от 0 до 14 (рис. «Шкала величин pH). 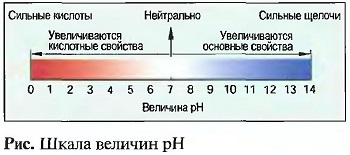 Водный раствор с величиной pH = 7 является нейтральным. Такую величину pH имеет дистиллированная вода. Растворы с величиной pH от 0 до 7 являются кислыми, чем меньше величина pH, тем кислее раствор. Растворы с величиной pH от 7 до 14 являются основными, чем больше величина pH, тем более основным или щелочным является раствор. Величину pH раствора определяют с помощью индикаторной (лакмусовой) бумажки или с помощью индикаторных растворов, а также с помощью электроприборов.
Водный раствор с величиной pH = 7 является нейтральным. Такую величину pH имеет дистиллированная вода. Растворы с величиной pH от 0 до 7 являются кислыми, чем меньше величина pH, тем кислее раствор. Растворы с величиной pH от 7 до 14 являются основными, чем больше величина pH, тем более основным или щелочным является раствор. Величину pH раствора определяют с помощью индикаторной (лакмусовой) бумажки или с помощью индикаторных растворов, а также с помощью электроприборов.
Серная кислота имеет величину pH = 1, углекислота имеет pH = 4. Величина pH гашеной извести составляет 12, натриевой щелочи — 13.
СВОЙСТВА:
- Щелочи окрашивают лакмусовую бумажку в синий цвет.
- Щелочи раздражают кожу и разрушают одежду.
- Щелочи растворяют жиры, некоторые щелочи растворяют растительные и животные ткани.
- Щелочи взаимодействуют с некоторыми металлами, например с алюминием.
- Щелочи — мыльные на ощупь.
- Щелочи защищают сталь от коррозии.
Кислоты и щелочи опасны, они могут храниться только в четко обозначенных этикетками сосудах, ни в коем случае не в сосудах из-под напитков. При работе с кислотами и щелочами нужны защитные очки.
РЕКОМЕНДУЮ ЕЩЕ ПОЧИТАТЬ: